




2023年发表在Nature Communications(IF=16.6)杂志上的一篇题为Organoid models of fibrolamellar carcinoma mutations reveal hepatocyte transdifferentiation through cooperative BAP1 and PRKAR2A loss的文章中。研究人员对人类肝细胞类器官进行CRISPR工程,使用 CRISPR-Cas9 修饰蛋白激酶 A (PKA) 复合体构建了肝脏类器官模型。研究表明,不同的基因突变导致不同的肿瘤侵袭性,并确定肝细胞为可能的起源细胞。了解特定基因缺陷在纤维板层癌(FLC)启动中的重要性,在未来也可能有助于更好地了解患者之间的肿瘤异质性和反应。

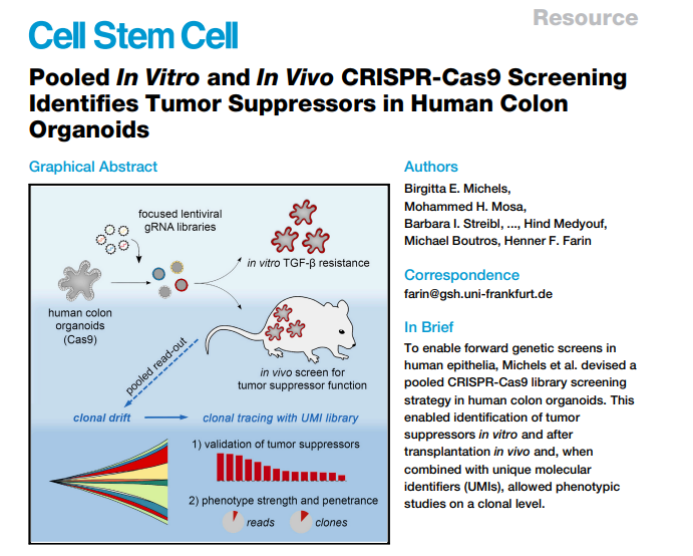
研究团队在Cell Stem Cell(IF=23.9)上在线发表题为 Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids的文章,开发了一个基于人类结肠类器官的CRISPR-Cas9基因筛选平台,使得利用类器官进行体外和体内移植后肿瘤抑制基因的筛选鉴定成为可能,并且当结合独特的分子识别物(UMI)时,可以实现在克隆水平上进行表型研究,对于肿瘤个性化治疗具有巨大的应用潜力。


2022年发表在Science子刊Science Translational Medicine(IF=17.1)题为Generation and multiomic profiling of a TP53/CDKN2A double-knockout gastroesophageal junction organoid model 的文章,该研究从健康人体组织中培育了一个贲门(GEJ)类器官,并使用CRISPR-Cas9基因编辑技术,把TP53和CDKN2A基因双敲除,模拟了癌症转化过程包括代谢和表观基因组等变化从而揭示了早期GEJ肿瘤的发生发展机制,并在此基础上发现了GEJ癌症的治疗靶点——血小板激活因子(PTAF),使用siRNA或小分子抑制剂抑制PTAF,能够减缓或停止GEJ肿瘤生长。这项研究不仅有助于识别GEJ肿瘤生长过程中发生的关键变化,还为未来的研究建立了策略,以帮助理解其他器官的肿瘤。


2023年在Nature Biotechnology(IF=68.164)发表了题为Engineered human hepatocyte organoids enable CRISPR-based target discovery and drug screening for steatosis的研究文章。该研究模拟了各种不同的脂肪变性触发因素,并研究了它们的相互作用;并且利用APOB和MTTP突变类器官建立了一个基于CRISPR的筛选平台,以识别脂肪变性调节剂/靶点,并评估NAFLD风险基因。


2020年Hans Clevers研究组在Nature Cell Biology(IF=21.3)杂志上发表文章Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing,利用非同源依赖的CRISPR-Cas9技术快速高效地对人源类器官进行基因敲入,建立了不依赖于对TP53活性抑制的以NHEJ介导的基因编辑技术,简化了基因敲入的流程,对于肝细胞等成体干细胞来源的类器官可视化研究提供了可靠的基因编辑方式。


2020年Hans Clevers研究组在Cell Stem Cell(IF=23.9)发表文献,题为 CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank ,利用CRISPR依赖的单碱基编辑技术,以囊性纤维化疾病 (Cystic Fibrosis) 病人样品建立起的类器官为样本,对致病基因CFTR (CF transmembrane conductance regulator gene) 中的突变进行编辑和修复,为临床上囊性纤维化疾病尤其是相对罕见的突变的修复提供了可参考的治疗方案,同时也为体外进行大规模药物筛选并对病人进行个性化医疗方案的设计提供了重要的数据库 。

将CRISPR技术运用在人类类器官模型上,在提升文章深度和水平的同时为疾病的机制研究提供了新的工具,并为进一步研究如何更好地治疗疾病奠定了研究基础。


































